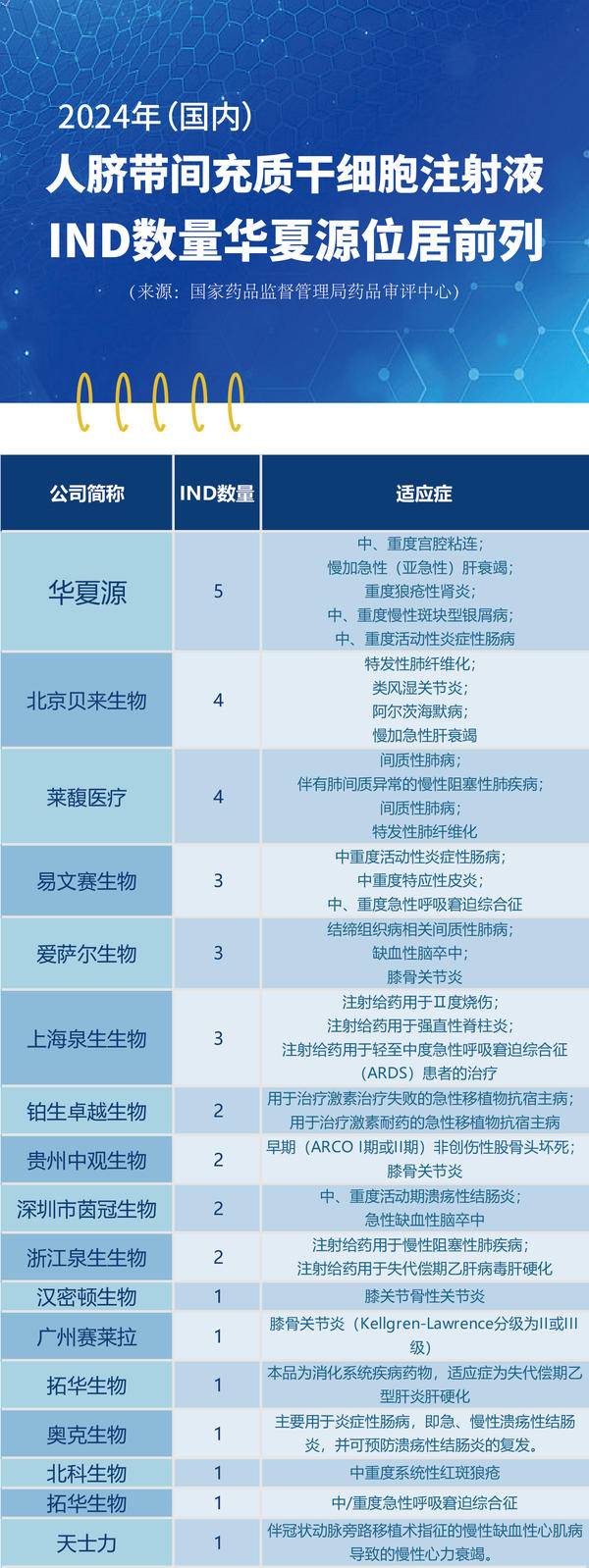
在细胞治疗的前沿领域,人脐带间充质干细胞(HUC-MSCs)注射液正成为各大生物医药企业竞相角逐的焦点。随着国家对细胞治疗技术的监管日益规范和重视,新药临床试验申请(IND)的获批情况已成为衡量企业在该领域研发实力和进展的重要指标。
截至2025年2月,中国在人脐带间充质干细胞治疗药物领域展现出强劲的研发势头。据公开信息统计,国家药品监督管理局药品审评中心(CDE)已受理并批准多款人脐带间充质干细胞注射液的临床试验申请(IND),包括华夏源、贝来生物、莱馥医疗等多家企业,覆盖血液系统、呼吸系统、心血管系统以及一些自身免疫系统疾病等多个领域。
(来源:国家药品监督管理局药品审评中心)
人脐带间充质干细胞是从新生儿脐带组织中提取的一类具有多向分化潜能的多能干细胞,以其免疫原性低、增殖能力强等特点显著,在再生医学领域展现出巨大的应用潜力。例如,华夏源自主研发的“ELPIS人脐带间充质干细胞注射液”,分别针对宫腔粘连、肝衰竭、重度狼疮性肾炎、慢性斑块型银屑病、活动性炎症性肠病;拓华生物的人脐带间充质干细胞注射液适应症为失代偿期乙型肝炎肝硬化;铂生卓越的艾米迈托赛注射液用于治疗激素治疗失败的急性移植物抗宿主病(aGVHD)。
根据前瞻产业研究院出具的《2024年中国干细胞行业市场研究报告》显示,2024年中国干细胞市场规模已达265亿元,从已获批IND的细胞类型来看,截至2024年10月,间充质干细胞药物合计78例,占比73.6%,是干细胞药物研发最主要的细胞类型。这一数据充分展示了间充质干细胞在细胞治疗领域的巨大市场潜力和发展前景。
2025年1月,国务院办公厅发布的《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》明确提出,要加速细胞与基因治疗药品的审批上市,为人脐带间充质干细胞药物的研发与产业化提供了有力的政策支持。
随着技术突破和政策支持的双重驱动,人脐带间充质干细胞注射液的适应症将进一步扩展,探索其在神经退行性疾病(如帕金森病)、代谢性疾病(如糖尿病)等领域的应用。同时,产业化进程也将进一步加快,预计未来3-5年内将有更多人脐带间充质干细胞药物获批上市,为更多患者带来福音。
中国健康在线本栏目发布信息,目的在于传播更多信息,丰富网络文化,稿件仅代表作者个人观点,与中国健康在线无关。其原创性以及中文陈述文字和文字内容未经本网证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本网不做任何保证或者承诺,请读者仅作参考,并请自行核实相关内容。凡注明为其他媒体来源的信息,均为转载自其他媒体,转载并不代表本网赞同其观点,也不代表本网对其真实性负责。您若对该稿件由任何怀疑或质疑,请即与中国健康在线联系,我们将迅速给您回应并做处理。